本品为人血液制品,因原料来自人血,虽然对原料血浆进行了相关病原体的筛查,并在生产工艺中加入了去除和灭活病毒的措施,但理论上仍存在传播某些已知和未知病原体的潜在风险,临床使用时应权衡利弊。
>国内首家血液制品GMP认证企业
>国内首家采用双重病毒灭活工艺用于生产
>国内首家采用全自动采浆机和全自动洗瓶灭菌罐装生产线的生产企业
>血浆优质安全,多道ELISA(酶联免疫法)和核酸扩增技术检测
>不含防腐剂和抗生素,纯度高,稳定性好
>全面与世界接轨的标准化体系认证

请仔细阅读说明书并在医师指导下使用
本品为人血液制品,因原料来自人血,虽然对原料血浆进行了相关病原体的筛查,并在生产工艺中加入了去除和灭活病毒的措施,但理论上仍存在传播某些已知和未知病原体的潜在风险,临床使用时应权衡利弊。
[药品名称]
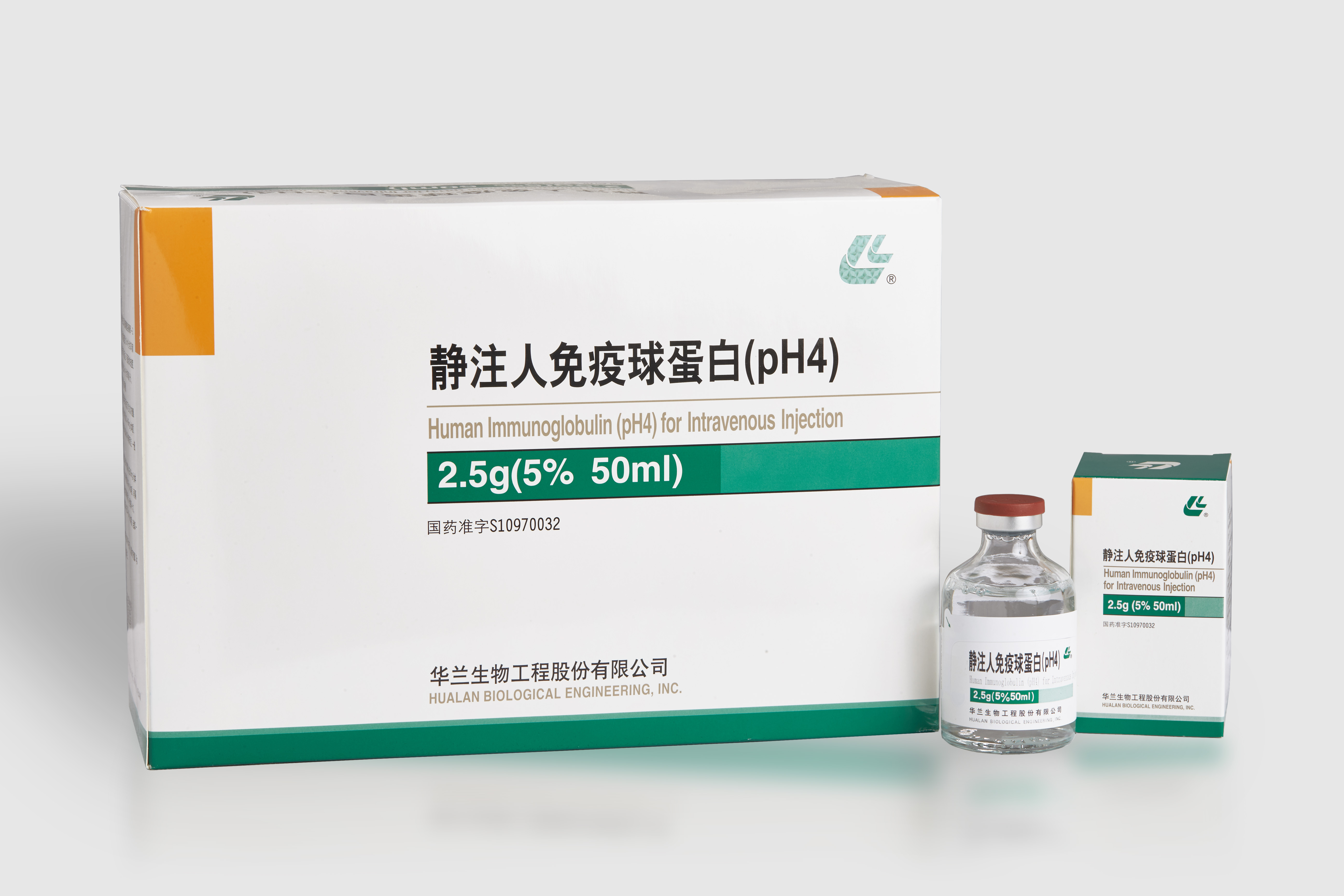
通用名称:静注人免疫球蛋白(pH4)
英文名称:Human Immunoglobulin (pH4) for Intravenous Injection
汉语拼音:Jingzhu Ren Mianyiqiudanbai(pH4)
[成份]
本品活性成份为人免疫球蛋白,主要是IgG,辅料为聚山梨酯80、麦芽糖、注射用水。
[性状]
本品应为无色或淡黄色澄明液体,可带轻微乳光,不应出现浑浊。
[适应症]
1.原发性免疫球蛋白缺乏症,如X联锁低免疫球蛋白血症,常见变异性免疫缺陷病,免疫球蛋白G亚型缺陷病等。
2.继发性免疫球蛋白缺陷病,如重症感染,新生儿败血症等。
3.自身免疫性疾病,如原发免疫性血小板减少症,川崎病。
[规格]
2.5g/瓶(5%,50ml)
[用法用量]
用法:静脉滴注或以5%葡萄糖溶液稀释1~2倍作静脉滴注,开始滴注速度为1.0ml/分钟(约20滴/分钟)持续15分钟后若无不良反应,可逐渐加快速度,最快滴注速度不得超过3.0ml/分钟(约60滴/1分钟)。
用量:遵医嘱。
推荐剂量:
1.原发性免疫球蛋白缺乏或低下症:首次剂量:400mg/kg体重;维持剂量:200~400mg/kg体重,给药间隔时间视病人血清IgG水平和病情而定,一般每月一次。
2.原发免疫性血小板减少症:每日400mg/kg体重,连续5日。维持剂量每次400mg/kg体重,间隔时间视血小板计数和病情面定,一般每周一次。
3.重症感染:每日200~300mg/kg体重,连续2~3日。
4.川崎病:发病10日内应用,儿童治疗剂量2.0g/kg体重,一次输注。
[不良反应]
输注时可能出现一过性头痛、心慌、恶心等不良反应,可能与输注速度过快或个体差异有关。上述反应大多发生在输注开始一小时内,因此建议在输注的全过程定期观察患者的一般情况和生命体征,必要时应减慢或暂停输注,一般无需特殊处理即可自行恢复。 个别患者可在输注结束后发生上述反应,一般在24小时内均可自行恢复。
1.国外临床试验
同类的国外上市产品在超过5%的临床试验受试者中观察到以下常见不良反应:头痛、寒战、发热、疼痛、乏力、背痛、思心、呕吐、腹痛、腹泻、输液部位反应、皮疹、瘙痒、荨麻疹、高血压、低血压、心动过速等。
2.国内上市后监测
本品及同类的国内上市产品监测到如下不良反应事件,由于这些不良反应/事件是在无法确定总数的人群中自发报告的,因此不能准确估算其发生率:
(1)全身性损害:畏寒,高热、胸痛、不适、苍白、乏力、眶周水肿、水肿、全身酸痛等。
(2)皮肤及其附件损害:斑丘疹、红斑性皮疹、局限性皮肤反应、表皮松解、多发性红斑、皮炎(如大疱性皮炎)、出汗增加等。
(8)免疫功能紊乱和感染:过敏反应、过敏样反应、输液反应、过敏性休克等。
(4)心血管系统损害:紫绀、心悸、高血压、心律失常等。
(5)神经系统损害:头晕、昏迷、意识丧失、震颤、肌肉不自主收缩、感觉减退等。
(6)呼吸系统损害:呼吸困难、呼吸急促、呼吸暂停、喘息、喉头水肿、呼吸功能不全、输血相关急性肺损伤、低氧血症等。
(7)血管损害和出凝血障碍:潮红、静脉炎等。
(8)精神障碍:激越、精神障碍、嗜睡等。
(9)代谢和营养障碍:高血糖。(注:药品成份中含糖类的,注明此项)
( 10)血液系统损害:白细胞减少、中性粒细胞减少、粒细胞缺乏等。
3.国外上市后监测
同类的国外上市产品还监测到如下不良反应事件,由于这些不良反应事件是在无法确定总数的人群中自发报告的,因此不能准确估算其发生率:
(1)皮肤及其附件损害:史蒂文斯-约翰逊综合征等。
(2)神经系统损害:癫痫发作、无菌性脑膜炎等。
(3)呼吸系统损害:急性呼吸窘迫综合征、肺水肿、支气管痉挛等。
(4)血管损害和出凝血障碍:血栓形成等。
(5)血液系统损害:血浆黏度增加、溶血反应等。
(6)泌尿系统损害:肾功能损害等。
[禁忌]
1.对人免疫球蛋白过敏或有其他严重过敏史者。
2.有抗IgA抗体的选择性IgA缺乏者。
[注意事项]
1.本品专供静脉输注用。
2.如需要,可以用5%葡萄糖溶液稀释本品,但糖尿病患者应慎用。
3.药液呈现混浊、沉淀、异物或瓶子有裂纹、过期失效等情况下,不得使用。
4.本品开启后,应一次输注完毕,不得分次或给第二人输用。
5.有严重酸碱代谢紊乱的患者应慎用。
6.监测急性肾功能衰竭患者的肾功能,包括血尿素氮、血肌酐和尿量。对于肾功能不全或衰竭的患者,要以最小的速度输注。易感患者使用本品可能引起肾功能异常。
7.可能发生血栓性事件。监测有血栓形成事件已知危险因素的患者;对有高粘血症风险患者的血液粘度进行基线评估。对于有血栓形成风险的患者,要在最小剂量下缓慢输注。
8.可能发生无菌性脑膜炎综合征,特别是在高剂量或快速输注时。
9.可能发生溶血性贫血。监测溶血和溶血性贫血患者的临床体征和症状。
[孕妇及哺乳期妇女用药]
未专门进行该项针对性试验研究,且无系统可靠的参考文献。对孕妇或可能怀孕妇女的用药应慎重,如有必要应用时,应在医师指导和严密观察下使用。
[儿童用药]
未专门进行该项针对性试验研究,且无系统可靠的参考文献。
[老年用药]
未进行该项试验研究,且无系统可靠的参考文献。在65岁以上的患者中,一般情况下,不超过推荐剂量,缓慢输注。
[药物相互作用]
本品尚无与其它药物相互作用的临床研究资料。因此本品须严格单独输注,不得与其他任何药物混合使用。
为了避免被动接受本品中特异性抗体的干扰,输注本品3个月后才能接种某些减毒活疫苗,如脊髓灰质炎、麻疹、风疹、腮腺炎以及水痘病毒疫苗等。基于同样的考虑,在非紧急状态下,已经接种了这类疫苗的患者至少在接种后3~4周才能输注本品;如果在接种后3~4周内使用了本品,则应在最后一次输注本品后3个月重新接种。
[药物过量]
未专门进行该项针对性试验研究,且无系统可靠的参考文献。过量使用可能导致患者循环血容量超载和血液粘度增高而增加心脏的负荷,此结果更常见于老年患者和肾功能损伤患者。
[药理毒理]
本品含有广谱病毒、细菌或其他病原体的IgG抗体,经静脉输注后,能迅速提高受者血液中的IgG水平,增强机体的抗感染能力和发挥免疫调节功能。
[药代动力学]
未专门进行该项针对性试验研究。文献报道,人免疫球蛋白生物半衰期约为3~4周。
[贮藏]
于2~8°C避光保存和运输。
[包装]
硼硅玻璃模制注射剂瓶、澳化丁基橡胶塞包装。1瓶/盒。
[有效期]
自生产之日起36个月。
[执行标准]
YBS10392020
[批准文号]
国药准字S10970032
[上市许可持有人]
名称:华兰生物工程股份有限公司
注册地址:河南省新乡市华兰大道甲1号
[生产企业]
企业名称:华兰生物工程股份有限公司
生产地址:河南省新乡市华兰大道甲1号
邮政编码:4530030
电话号码:(0373) 3519992
传真号码:(0373) 3519991
网址: http://www.hualanbio.com